2020年5月,醫療器械CE認證法規將開始在歐盟申請(法規(EU)2017/745),該法規于2017年生效,并廢除了之前的現行指令。它意味著對公司的新要求并涵蓋更多產品,因此,在這個新的截止日期臨近時,謹慎是至關重要的。
新的醫療器械法規?
1、范圍更廣
隨著新的醫療器械法規在歐盟生效,現在涵蓋了更多的產品。具有非醫療目的的醫療器械現在屬于法規范圍。
具有美學目的的這些裝置列于該法規的附件XVI中,并且可能在臨界產品方面存在問題(在兩個法規之間)。這些附件XVI產品可以是例如強脈沖光設備,乳房假體,或甚至具有美學目的的隱形眼鏡。
其他法規之間也存在邊界產品。例如,可以考慮口腔護理產品,這取決于產品,醫療裝置或化妝品。我們即將發布一篇關于醫療器械臨界產品的文章,以便更容易識別。
2、新的分類規則
分類修改很重要,該規定將分類規則的數量從18個增加到22個,舊的指令I類設備現在可能被視為IIa類,具有這一新規定。預計截止日期和謹慎是必不可少的。
3、加強監督
歐洲法規的主要目標仍然是保護消費者。在這里,它更具體地協調了設備安全方面的要求。
一個更好的市場預評估現在需要。為此,必須提供更多信息和數據。每個州的通知機構現在都處于歐洲控制之下,保證每個州都有相同的要求標準。
上市后安全監測也得到了改善。公司不僅需要定期報告設備安全性,而且還將在歐洲范圍內實施新的監控工具。
實際上,歐洲聯盟目前正在開發一個歐洲醫療設備數據庫--EUDAMED,它應該在2020年3月25日之前投入使用。后者將允許經營者來注冊自己和醫療設備,同時也集中臨床研究,警惕,市場監管等。當然,所有的數據將不會被公開。此數據庫將與唯一設備標識符(或UDI)系統一起使用。UDI將由設備標識符和生產單元標識符組成。
截止日期和關鍵日期
該規定將于2020年5月26日起實施,其中準指令以完整的形式廢除,但還有其他日期需要記住。這是一個快速摘要:
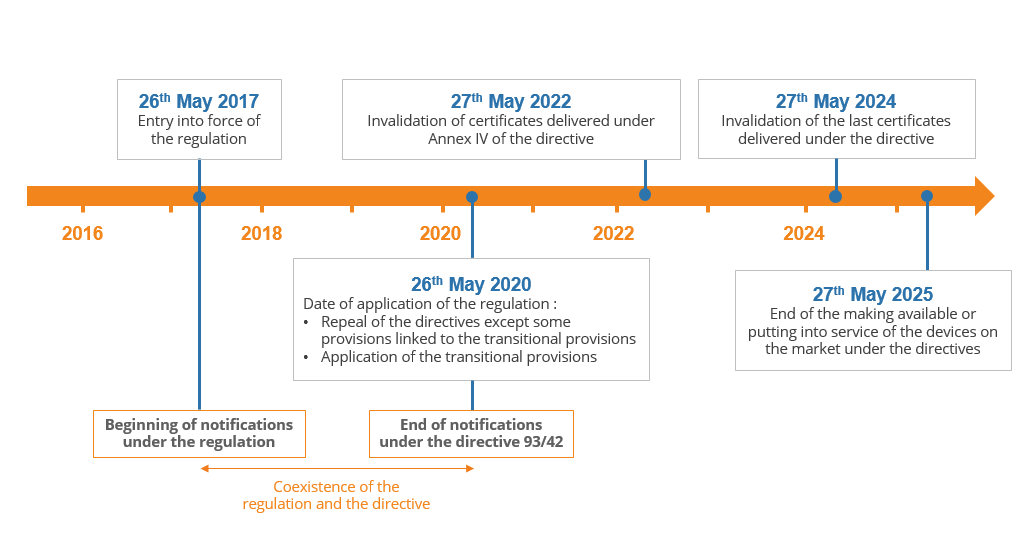
該法規的實施將持續數年:
1.在申請之日,即2020年5月,所有類別的設備都需要遵守該規定,
2.在2022年至2024年之間,根據指令交付的證書將失效,
3.2024年5月27日,由于最后證書無效,所有IIa至III類醫療器械必須遵守該規定,
4.根據該指令合法商業化的設備仍可在市場上銷售或投入使用,直至2025年5月27日。
我們的專家將負責處理從I級到IIa級的醫療設備的注冊。由于他們對這項新法規的深入了解,我們的專家會為您提供最佳預測未來期限的策略建議。
背景:為什么這個規定?
迄今為止,歐洲指令規定醫療器械的營銷可追溯到1990年,對于最老的醫療器械。作為指令,它們沒有直接適用性,因此必須轉換為每個州的國家立法。
因此,每個成員國都可以自由地解釋文本,從而在其應用中產生差異。
一個監管然而,有直接適用于所有成員國,并允許這個原因,統一的要求,關于醫療器械的銷售。
